Introdução à Isomeria Espacial Geométrica
Exemplo De Isomeria Espacial Geometrica Por Massas Molares Com Barras – Isomeria espacial geométrica, também conhecida como isomeria cis-trans, ocorre em moléculas com ligações duplas ou em sistemas cíclicos, onde a rotação em torno da ligação é restrita. Esta restrição leva à existência de isômeros com diferentes arranjos espaciais dos átomos, apesar de possuírem a mesma fórmula molecular. A compreensão desta isomeria é crucial em diversas áreas, desde a síntese orgânica até a bioquímica.
Tipos de Isomeria Espacial Geométrica: Isômeros Cis e Trans
Os dois principais tipos de isômeros geométricos são os isômeros cis e trans. Em isômeros cis, os grupos substituintes de maior prioridade estão do mesmo lado do plano da ligação dupla ou do anel. Em isômeros trans, esses grupos estão em lados opostos. A nomenclatura cis e trans, derivadas do latim ( cis = deste lado e trans = através de), reflete diretamente a posição relativa desses substituintes.
Influência da Rotação em Torno da Ligação Simples na Isomeria Geométrica
A rotação livre em torno de ligações simples permite a interconversão de conformações diferentes, mas não afeta a isomeria geométrica. A isomeria geométrica é definida pela rigidez da ligação dupla (ou sistema cíclico), que impede a livre rotação e, portanto, mantém os isômeros distintos.
Nomenclatura de Isômeros Geométricos
Além da nomenclatura cis-trans, a nomenclatura E-Z, baseada nas regras de prioridade de Cahn-Ingold-Prelog, é utilizada para descrever isômeros geométricos, especialmente em casos mais complexos com múltiplos substituintes na ligação dupla. A prioridade dos substituintes é determinada pela massa atômica dos átomos diretamente ligados ao carbono da dupla ligação. Se os grupos de maior prioridade estiverem do mesmo lado, o isômero é designado como Z (do alemão zusammen, significando “juntos”); se estiverem em lados opostos, o isômero é designado como E (do alemão entgegen, significando “opostos”).
Massas Molares e Isomeria Geométrica
Apesar de possuírem a mesma fórmula molecular, isômeros geométricos podem apresentar propriedades físicas diferentes, incluindo pontos de fusão, pontos de ebulição e solubilidade. No entanto, suas massas molares são idênticas. Isso ocorre porque a massa molar é a soma das massas atômicas de todos os átomos na molécula, e a fórmula molecular é a mesma para ambos os isômeros.
Comparação das Massas Molares de Isômeros Geométricos
A massa molar não serve para diferenciar isômeros geométricos. A semelhança nas massas molares entre isômeros geométricos destaca que a diferença entre eles reside na disposição espacial dos átomos e não na composição atômica.
Cálculo da Massa Molar de Compostos com Isomeria Geométrica
O cálculo da massa molar é realizado da mesma forma para ambos os isômeros geométricos, somando-se as massas atômicas de cada átomo presente na molécula. Por exemplo, o ácido butenodióico (ácido maléico e ácido fumárico, isômeros geométricos) possui a mesma massa molar, independente de ser o isômero cis ou trans.
| Nome do Composto | Fórmula Molecular | Massa Molar (g/mol) | Tipo de Isomeria |
|---|---|---|---|
| Ácido Maléico (cis) | C4H4O4 | 116.07 | Geométrica (cis) |
| Ácido Fumárico (trans) | C4H4O4 | 116.07 | Geométrica (trans) |
| 1,2-Dicloroeteno (cis) | C2H2Cl2 | 96.95 | Geométrica (cis) |
| 1,2-Dicloroeteno (trans) | C2H2Cl2 | 96.95 | Geométrica (trans) |
Representação de Isômeros Geométricos com Barras
Modelos de barras e esferas são ferramentas úteis para visualizar a disposição espacial dos átomos em moléculas, facilitando a distinção entre isômeros geométricos. As barras representam as ligações químicas, e as esferas representam os átomos.
Métodos de Representação com Barras e Esferas
Utilizando modelos de barras e esferas, a diferença entre isômeros cis e trans fica evidente pela posição relativa dos átomos ou grupos de átomos em relação à ligação dupla ou ao plano do anel. A representação em 2D pode ser complementada por projeções, como a projeção de Newman, para melhor visualização da estereoquímica.
Representação em Barras: Exemplo Cis e Trans
Em um isômero cis de um composto com ligação dupla, os grupos de maior prioridade estão do mesmo lado da ligação dupla. Já em um isômero trans, eles estão em lados opostos. A visualização através de modelos de barras e esferas torna essa distinção imediatamente clara. Por exemplo, no 2-buteno, o isômero cis mostraria os dois grupos metil do mesmo lado da ligação dupla, enquanto no isômero trans, eles estariam em lados opostos.
Eficácia da Representação com Barras e Esferas
A representação com barras e esferas é mais eficaz que as fórmulas estruturais bidimensionais para identificar a isomeria geométrica, pois permite a visualização tridimensional da molécula, revelando a disposição espacial dos átomos e, consequentemente, a diferença entre os isômeros.
Exemplos de Isomeria Geométrica com Massas Molares Diferentes
Embora as massas molares sejam iguais para isômeros geométricos, suas propriedades físicas e químicas podem diferir significativamente devido às suas diferentes estruturas tridimensionais.
Exemplos de Compostos com Isomeria Geométrica
- 2-Buteno: O cis-2-buteno apresenta um momento dipolar maior que o trans-2-buteno devido à disposição dos grupos metil. Ambos possuem massa molar de 56,11 g/mol. A representação em barras mostraria os grupos metil no mesmo lado ( cis) ou em lados opostos ( trans) da ligação dupla.
- Ácido 1,2-Dicloroeteno: O cis-1,2-dicloroeteno e o trans-1,2-dicloroeteno possuem a mesma massa molar (96,95 g/mol), mas o isômero cis apresenta maior ponto de ebulição devido às interações dipolo-dipolo mais fortes. A representação em barras mostraria os átomos de cloro no mesmo lado ( cis) ou em lados opostos ( trans) da ligação dupla.
- Ácido maléico e fumárico: O ácido maléico ( cis) e o ácido fumárico ( trans) são isômeros geométricos do ácido butenodióico. Ambos possuem massa molar de 116,07 g/mol, porém apresentam diferenças significativas em suas propriedades físicas, como ponto de fusão e solubilidade em água, devido à sua geometria diferente. A representação em barras mostraria os grupos carboxila no mesmo lado ( cis) ou em lados opostos ( trans) da ligação dupla.
Aplicações da Isomeria Geométrica
A isomeria geométrica desempenha um papel crucial em diversas áreas, influenciando as propriedades e funcionalidades de moléculas em diferentes contextos.
Isomeria Geométrica na Indústria Farmacêutica, Exemplo De Isomeria Espacial Geometrica Por Massas Molares Com Barras
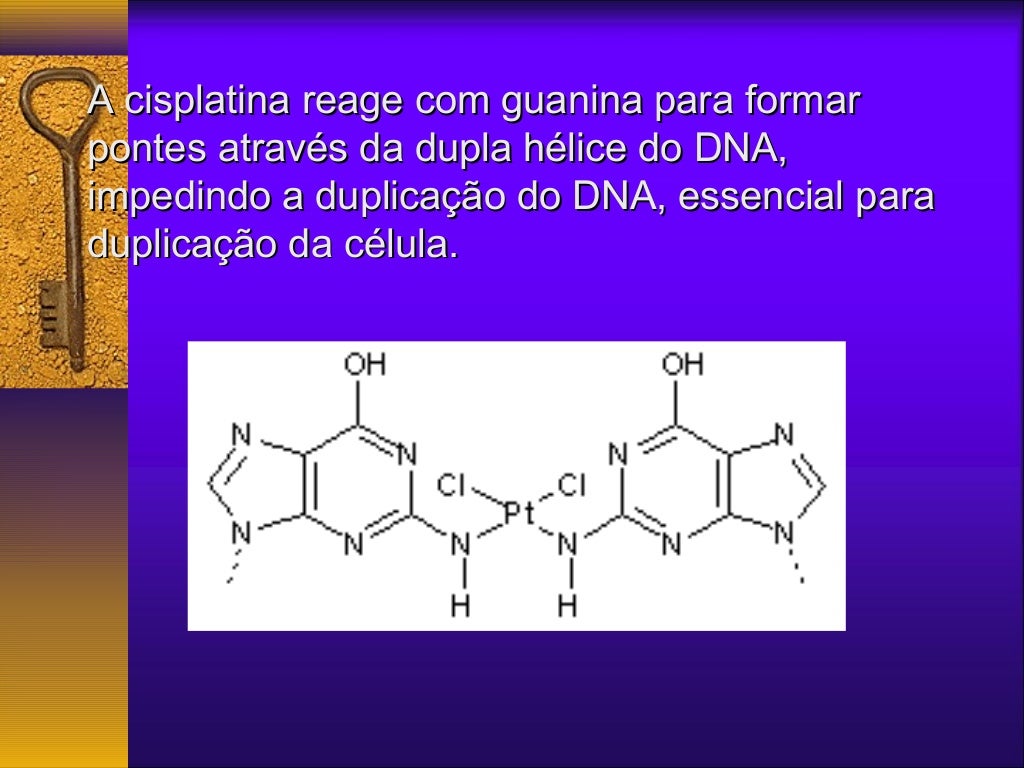
Na indústria farmacêutica, a isomeria geométrica é de extrema importância, pois isômeros geométricos podem exibir atividades biológicas diferentes, ou até mesmo opostas. Um exemplo clássico é o caso do fármaco cisplatina, usado no tratamento de câncer, onde apenas o isômero cis possui atividade anticâncer significativa. O isômero trans é inativo.
Isomeria Geométrica na Química de Materiais
Na química de materiais, a isomeria geométrica pode afetar as propriedades físicas de polímeros e outros materiais. A disposição espacial dos grupos substituintes pode influenciar a cristalinidade, a resistência mecânica e outras propriedades importantes.
Importância da Identificação Precisa de Isômeros Geométricos
A identificação precisa dos isômeros geométricos é essencial para garantir a eficácia e segurança de medicamentos, bem como para controlar as propriedades dos materiais. Técnicas espectroscópicas, como a espectroscopia de infravermelho e ressonância magnética nuclear (RMN), são amplamente utilizadas para essa finalidade.
Considerações Adicionais sobre Isomeria Geométrica: Exemplo De Isomeria Espacial Geometrica Por Massas Molares Com Barras
Vários fatores influenciam as propriedades e reatividade dos isômeros geométricos.
Estabilidade Relativa de Isômeros Cis e Trans
Geralmente, os isômeros trans são mais estáveis que os isômeros cis devido à menor repulsão estérica entre os substituintes. No entanto, existem exceções dependendo da natureza dos substituintes e do tamanho do anel em sistemas cíclicos.
Propriedades Espectroscópicas de Isômeros Geométricos
Isômeros geométricos exibem diferenças em seus espectros de infravermelho (IV) e ressonância magnética nuclear (RMN). Essas diferenças são resultado das diferentes geometrias moleculares e podem ser utilizadas para a identificação e caracterização dos isômeros.
Influência da Isomeria Geométrica na Reação Química
A isomeria geométrica do reagente pode influenciar o produto formado em uma reação química. Por exemplo, em reações de adição eletrofílica, a estereoquímica do produto pode ser afetada pela estereoquímica do reagente.
Como a isomeria geométrica afeta a solubilidade de um composto?
A solubilidade pode ser afetada pela polaridade da molécula. Isômeros cis, geralmente mais polares que os trans, tendem a ser mais solúveis em solventes polares.
Quais técnicas espectroscópicas são úteis para distinguir isômeros geométricos?
Espectroscopia de infravermelho (IV) e Ressonância Magnética Nuclear (RMN) são ferramentas eficazes para diferenciar isômeros geométricos, devido às diferenças em seus momentos dipolares e deslocamentos químicos.
Existe alguma relação entre a isomeria geométrica e a atividade óptica?
Nem todos os isômeros geométricos são opticamente ativos. Apenas aqueles que possuem um carbono quiral (ou centro assimétrico) irão exibir atividade óptica.

