Em Que Consiste Uma Reaçao De Dupla-Troca Cite Um Exemplo? As reações de dupla-troca, também conhecidas como reações de metátese, são um tipo fundamental de reação química que envolve a troca de íons entre dois reagentes. Essas reações são amplamente observadas em diversas áreas da química, incluindo a síntese de novos compostos, a purificação de substâncias e o estudo de reações de precipitação.
Para que uma reação de dupla-troca ocorra, é essencial que pelo menos um dos produtos formados seja insolúvel em água, um gás ou água. Essa condição garante que a reação prossiga em uma direção favorável, deslocando o equilíbrio para a formação dos produtos.
Os principais tipos de reações de dupla-troca incluem reações de precipitação, neutralização e formação de gás, cada uma com suas características e aplicações específicas.
Introdução à Reação de Dupla-Troca
Uma reação de dupla-troca, também conhecida como reação de metátese, é um tipo de reação química que envolve a troca de íons entre dois reagentes. Em outras palavras, os cátions e ânions dos reagentes trocam de parceiros para formar novos produtos.
Para que uma reação de dupla-troca ocorra, é essencial que um dos produtos formados seja insolúvel em água (precipitado), um gás ou água. Essa condição garante que a reação ocorra espontaneamente e que haja uma mudança observável na mistura reacional.
Tipos de Reações de Dupla-Troca
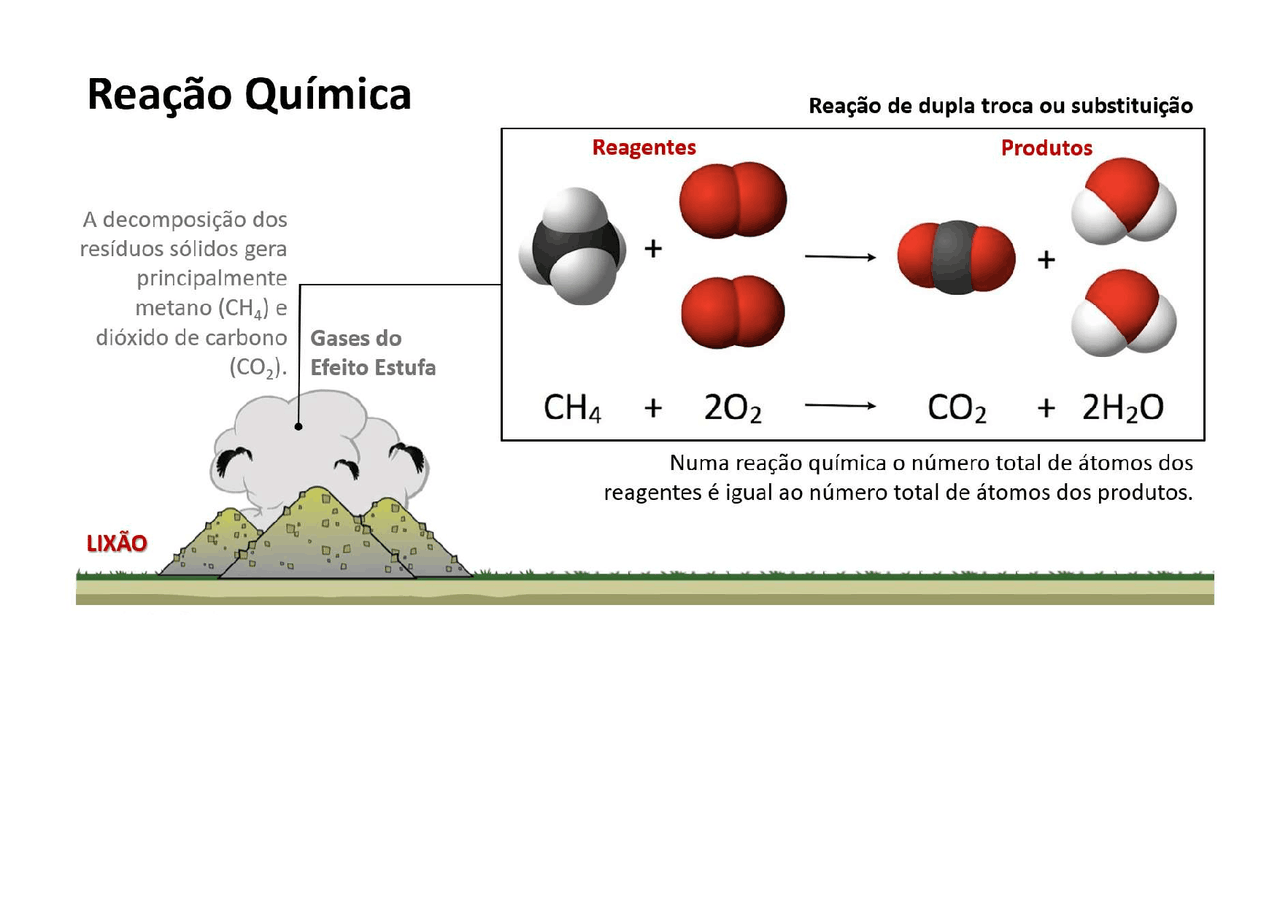
As reações de dupla-troca podem ser classificadas em três tipos principais, cada um com características e exemplos específicos:
- Reação de Precipitação:Ocorre quando dois reagentes aquosos reagem para formar um produto insolúvel, que precipita para fora da solução. Um exemplo clássico é a reação entre cloreto de bário (BaCl 2) e sulfato de sódio (Na 2SO 4), formando sulfato de bário (BaSO 4) insolúvel e cloreto de sódio (NaCl) solúvel.
A equação química balanceada para essa reação é:
| Tipo de Reação | Equação Química | Reagentes | Produtos |
|---|---|---|---|
| Precipitação | BaCl2(aq) + Na2SO4(aq) → BaSO4(s) + 2NaCl(aq) | Cloreto de bário, Sulfato de sódio | Sulfato de bário (precipitado), Cloreto de sódio |
- Reação de Neutralização:Ocorre quando um ácido reage com uma base para formar sal e água. Um exemplo comum é a reação entre ácido clorídrico (HCl) e hidróxido de sódio (NaOH), formando cloreto de sódio (NaCl) e água (H 2O). A equação química balanceada para essa reação é:
| Tipo de Reação | Equação Química | Reagentes | Produtos |
|---|---|---|---|
| Neutralização | HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) | Ácido clorídrico, Hidróxido de sódio | Cloreto de sódio, Água |
- Reação de Formação de Gás:Ocorre quando dois reagentes reagem para formar um gás como produto. Um exemplo típico é a reação entre ácido clorídrico (HCl) e carbonato de cálcio (CaCO 3), formando cloreto de cálcio (CaCl 2), água (H 2O) e dióxido de carbono (CO 2), que é liberado como gás.
A equação química balanceada para essa reação é:
| Tipo de Reação | Equação Química | Reagentes | Produtos |
|---|---|---|---|
| Formação de Gás | 2HCl(aq) + CaCO3(s) → CaCl2(aq) + H2O(l) + CO2(g) | Ácido clorídrico, Carbonato de cálcio | Cloreto de cálcio, Água, Dióxido de carbono |
Exemplos de Reações de Dupla-Troca
Um exemplo clássico de uma reação de dupla-troca é a reação entre nitrato de prata (AgNO 3) e cloreto de sódio (NaCl), formando cloreto de prata (AgCl) insolúvel e nitrato de sódio (NaNO 3) solúvel. A equação química balanceada para essa reação é:
AgNO 3(aq) + NaCl(aq) → AgCl(s) + NaNO 3(aq)
Nessa reação, os íons prata (Ag +) do nitrato de prata reagem com os íons cloreto (Cl –) do cloreto de sódio para formar o cloreto de prata (AgCl), que é insolúvel em água e precipita para fora da solução como um sólido branco.
Os íons sódio (Na +) e nitrato (NO 3–) permanecem em solução como íons livres.
| Reagente 1 | Reagente 2 | Produto 1 | Produto 2 |
|---|---|---|---|
| Nitrato de prata (AgNO3) | Cloreto de sódio (NaCl) | Cloreto de prata (AgCl) | Nitrato de sódio (NaNO3) |
Aplicações da Reação de Dupla-Troca
As reações de dupla-troca são amplamente utilizadas em diversas áreas, como a química, a biologia e a indústria. Por exemplo, essas reações são empregadas na produção de medicamentos, fertilizantes, tratamento de água, produção de papel e muitos outros processos.
Em síntese orgânica, as reações de dupla-troca são usadas para preparar novos compostos, por exemplo, na produção de ésteres, que são utilizados em perfumes, sabões e outros produtos.
Na indústria de tratamento de água, as reações de dupla-troca são usadas para remover íons indesejáveis da água, como íons de cálcio e magnésio, que causam dureza da água.
As reações de dupla-troca também são usadas na produção de fertilizantes, como o sulfato de amônio, que é um fertilizante nitrogenado importante para o crescimento das plantas.
Considerações Adicionais

A velocidade e o rendimento de uma reação de dupla-troca podem ser influenciados por diversos fatores, como a concentração dos reagentes, a temperatura, a presença de catalisadores e o pH da solução. A estequiometria é crucial para determinar as quantidades de reagentes e produtos em uma reação, garantindo que a reação ocorra de forma completa e eficiente.
Para identificar e caracterizar os produtos formados em uma reação de dupla-troca, diversas técnicas podem ser utilizadas, como a espectrofotometria, a cromatografia e a análise elementar.
As reações de dupla-troca desempenham um papel crucial em diversas áreas da química e da indústria. Compreender os princípios básicos dessas reações, como a troca de íons e a formação de produtos insolúveis, permite prever o curso das reações e otimizar seus rendimentos.
Ao explorar os exemplos e aplicações de reações de dupla-troca, podemos apreciar a importância desse tipo de reação na produção de medicamentos, fertilizantes, tratamento de água e outras áreas de relevância.
Questions and Answers: Em Que Consiste Uma Reaçao De Dupla-Troca Cite Um Exemplo
Quais são as principais características de uma reação de dupla-troca?
As principais características de uma reação de dupla-troca são a troca de íons entre dois reagentes e a formação de um produto insolúvel, um gás ou água.
Como posso saber se uma reação é de dupla-troca?
Para identificar uma reação de dupla-troca, observe se há a formação de um precipitado, a liberação de um gás ou a produção de água como produto da reação.
Quais são as aplicações práticas das reações de dupla-troca?
As reações de dupla-troca são amplamente utilizadas na síntese de compostos inorgânicos, na purificação de substâncias, na produção de medicamentos e na indústria química.

